-
http://physique.chimie.pagesperso-orange.fr/1S_Chimie/1_S_Chimie_6_REACTIONS_ACIDO_BASIQUES.htm
http://montblancsciences.free.fr/premiere_old/chimie/cours/c06.htm
 votre commentaire
votre commentaire
-
BIENVENUE !
Nous sommes Hugo, Nathan et Solene, élèves en 1S au lycée Notre Dame du Voeu à Hennebont et c'est dans le cadre de nos Travaux Personnels Encadrés de que nous avons décidé de créer ce blog.Aussi nous avons choisi comme thème la mesure pour notre TPE. C'est un sujet qui nous a permis de traiter aussi bien les Sciences et Vie de la Terre que les Sciences Physiques, notre choix s'étant porté sur un domaine assez vaste, cela nous a permis d'étudier de nombreuses thématiques.
Problématique du TPE :
Le goût est-il le même pour tous?
 1 commentaire
1 commentaire
-
Au cours de ces expériences, nous en avons donc observé que la langue possède des papilles filiformes qui ont à leurs surfaces des bourgeons gustatifs. Celles-ci sont donc responsables du ressenti du pétillement sur la langue. Ce pétillement provient d'une réaction acido-basique qui est influencée par la température et la viscosité du milieu. Ces papilles envoient alors un message nerveux dans le cortex cérébral. Ce message va se séparer dans l’hypothalamus (émotions) et dans le thalamus (image multi-sensorielle). Après s'être scindées, les deux parties vont se retrouver. Cette jonction va provoquer la libération de dopamine. Grâce à plusieurs expériences et à des recherches approfondies, nous pouvons dire que le goût n'est pas le même pour tous, car le traitement des messages transmis par les bourgeons gustatifs par le cerveau est différent selon les individus.
 3 commentaires
3 commentaires
-
 Afin de démontrer l'importance de la viscosité dans l'appréhension du goût, nous avons utilisé lors de nos expériences des bonbons acidulés (têtes brulées) pour mettre en évidence ce phénomène. Nous avons donc immergé nos bonbons dans plusieurs solutions (eau chaude, eau froide et salive) qui présentaient des viscosités et des températures différentes
Afin de démontrer l'importance de la viscosité dans l'appréhension du goût, nous avons utilisé lors de nos expériences des bonbons acidulés (têtes brulées) pour mettre en évidence ce phénomène. Nous avons donc immergé nos bonbons dans plusieurs solutions (eau chaude, eau froide et salive) qui présentaient des viscosités et des températures différentesCi-dessus les tubes contenant la salive(1) et l'eau chaude(2) avec les têtes brulées immergées
Dans le premier tube nous pouvons observer une réaction importante provoquée par le bonbon au contact de la salive. Dans le second tube contenant le bonbon et l'eau froide: absence de réaction
Ci-dessus la réaction entre le mélange acide malique, citrique, lactique, le bicarbonate de soude (principaux composants du bonbon) et la salive (deuxième tube en partant de la droite), nous pouvons observer un dégagement gazeux important.
Une fois les réactions terminées, présentation des tubes
Télécharger « IMG_0214.MOV » (lien en cours de création) Vidéo avec eau froide+composants du bonbon acidulé
Télécharger « IMG_0212.MOV » (lien en cours de création) Vidéo avec eau chaude+composants du bonbon acidulé
Lorsque la salive entre en contact avec les ingrédients du bonbon, il se produit une réaction chimique. En effet, un gaz carbonique se dégage (comme dans les boissons gazeuses). Dans notre cas le dégagement gazeux est du à une réaction entre le bicarbonate de soude qui joue le rôle d'une base et les acides malique, citrique, lactique dans un milieu aqueux (salive ou eau).
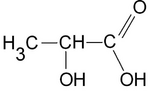
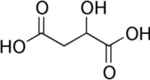
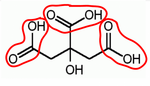
Nous avons vu que les acides ainsi que le bicarbonate de soude possédaient un (ou plusieurs) groupe carboxyle. Un groupe de carboxyle noté COOH, a un rôle essentiel dans la réaction acido-basique. En effet, les groupes carboxyle( se trouvant dans les acides) cèdent un proton H+qui lui va être capter par une base c'est donc ce qu'on appelle la réaction acido-basique. Lors de notre expérience, nous avons remarqué que plusieurs acides réagissaient avec la base. Prenons par exemple, l'acide lactique qui réagit avec le bicarbonate. L'ion Na+ (sodium) ne participant pas à la réaction il est spectateur.
L'équation de la réaction acido-basique est:
C3H6O3+HCO3- -> C3H5O3- +H2C03
On voit que l'acide lactique ne comprend qu'un groupe d'acide carboxyle, donc il ne cède qu'un ion H+ qui sera capté par le bicarbonate de soude. On en conclut que l'acide citrique et malique se comporte de la même façon que l'acide lactique. Ils cèderont alors un ou plusieurs ions H+ selon le nombre de groupes carboxyle qui le composent.
- On remarque que les molécules H2CO3 produit du CO2 et du H2O.
- H2CO3->CO2+H2O
Donc l'importance de l'effervescence dépend en partie du nombre de groupes carboxyle contenus dans l'espèce chimique étudiée car chaque groupe peut réagir. Lors des expériences, nous avons remarqué que dans les milieux aqueux froids et dans les milieux aqueux chauds, la vitesse des réactions étaient différentes, plus rapide dans l'eau chaude que dans l'eau froide.
Nous déduisons que la vitesse de la réaction est influencée par la température de la solution. La réaction acido-basique est donc en partie liée à la température. C'est une mesure de l'énergie thermique des molécules qui est déterminée par l'énergie cinétique développée par les molécules ( la force avec laquelle elles s'agitent). En effet plus la température augmente plus les molécules s'agitent. C'est donc cette vibration qui est responsable de la rupture des liaisons covalentes entre les molécules mais aussi du changement d'état de la matière. Les liaisons entre les atomes sont donc fragilisées par cette agitation, le départ de l'ion H+ est facilité.
Pour conclure, le pétillement provient d'une réaction acido-basique, la rapidité de cette réaction dépend de la température et de la viscosité du milieu.
 votre commentaire
votre commentaire
-
Tout d'abord, la salive est un liquide biologique sécrétée par les glandes salivaires, à l'intérieur de la bouche. Elle est composée à 99% d'eau, de protéines et de sels minéraux. C'est une solution aqueuse et visqueuse, sa viscosité varie de 1,5 à 13,4 centipoises alors que l'eau a une viscosité de 1 centipoise (cf expériences ci-dessous). Pour un liquide, la viscosité diminue lorsque la température augmente. On en déduit que la réaction avec la salive, lors de l'absorption d'un aliment dans notre bouche, est beaucoup plus lente qu'avec de l'eau, car sa viscosité est plus importante. C'est pourquoi, lors de nos expériences, nous avons pu le mettre en évidence.
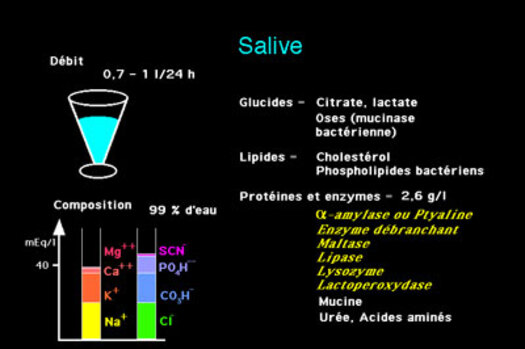
Définitions:
Un acide est une espèce chimique, ionique ou moléculaire, pouvant céder (au moins) un proton H+
Une base est une espèce chimique, ionique ou moléculaire, pouvant capter (au moins) un proton H+
Un couple acide-base est constitué d'un acide A et d'une base b conjugués, reliés par la demi équation protonique: acide=base+ H+
La réaction acido-basique est une réaction chimique au cours de laquelle se produit un transfert d'un ou plusieurs ions H+ en solution aqueuse. L'espèce chimique qui capte ces ions est appelée base et celle qui les cède acide
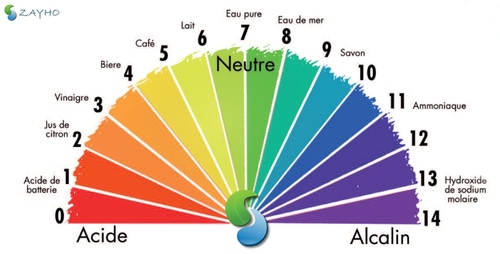
Le pH (potentiel hydrogène) nous permet de mesurer la concentration en ions oxonium. Une solution est neutre lorsque son pH est égal à 7. Dans un milieu aqueux les acides et les bases réagissent ensemble. En effet, l'acide cède un proton H+ capté par la base, qui est dite conjuguée à l'acide, on appelle cela la réaction acido-basique.
L'eau est un cas particulier car elle peut se comporter comme un acide ou comme une base, elle est dite ampholyte.
- Lorsqu'elle se comporte comme une base, son acide conjugué est l'oxonium: H2O+H+->H3O+
- Lorsqu'elle se comporte comme un acide, sa base conjuguée est l'ion hydroxyde HO-: H2O->HO-+H+
- Lors de notre expérience l'eau se comporte comme une base car elle capte un proton H+ d'un acide.
- Les composants principaux des des bonbons que nous étudions sont l'acide citrique, lactique, malique et le bicarbonate de soude.
 votre commentaire
votre commentaire Suivre le flux RSS des articles
Suivre le flux RSS des articles Suivre le flux RSS des commentaires
Suivre le flux RSS des commentaires